49) Chemické vazby
Created by Martin Krejzek

Kovalentní sloučeniny
- Jsou obvykle ve vodě nerozpustné
- Rozpouštějí se v organických rozpouštědlech
Iontové sloučeniny
- Jsou většinou dobře rozpustné ve vodě
- Jejich vodné roztoky obsahují volné ionty
Kovalentní sloučeniny
- Neobsahují ionty
- Proto jejich roztoky ani taveniny nevedou elektrický proud
Kovalentní sloučeniny
- Mají nízké teploty tání
- Mnohé z nich jsou za normálních podmínek těkavé kapaliny nebo plyny
- Také teploty varu mnoha kovalentních sloučenin jsou velmi nízké
- To je způsobeno slabými přitažlivými silami mezi jednotlivými molekulami
Iontové sloučeniny
- Mají vysoké teploty tání (až 2 000 0C)
- Protože v iontových krystalech jsou mezi ionty silné přitažlivé elektrostatické síly
- Vysoká teplota je nutná k porušení této krystalové struktury
Rozpustnost

Iontové sloučeniny
- V pevném stavu jsou elektricky nevodivé
- Jejich roztoky a taveniny však vedou elektrický proud, protože v nich jsou přítomny volné ionty
Elektrické vlastnosti

Teplota tání a varu
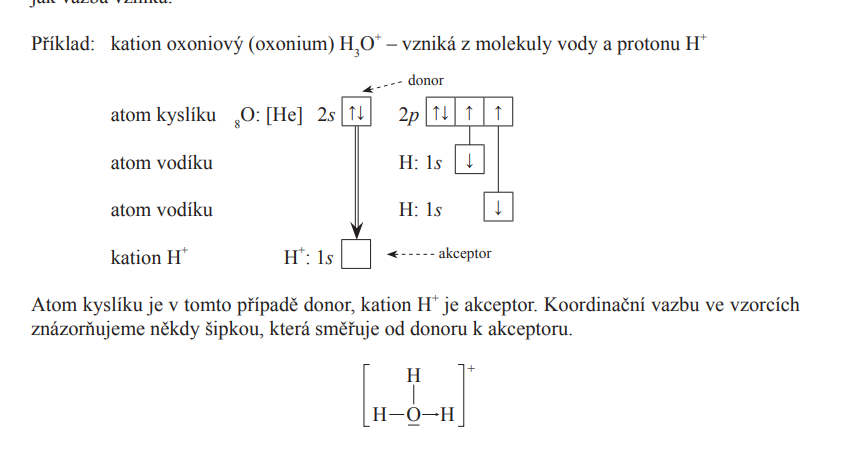
Koordinačně kovalentní vazba
- Jeden atom - donor, poskytne oba elektrony potřebené ke vzniku vazby
- Druhý atom - akceptor, oba elektrony přijme, protože má ve své valenční vrstvě volný orbital
- 2+
- viz sešit
Iontová vazba
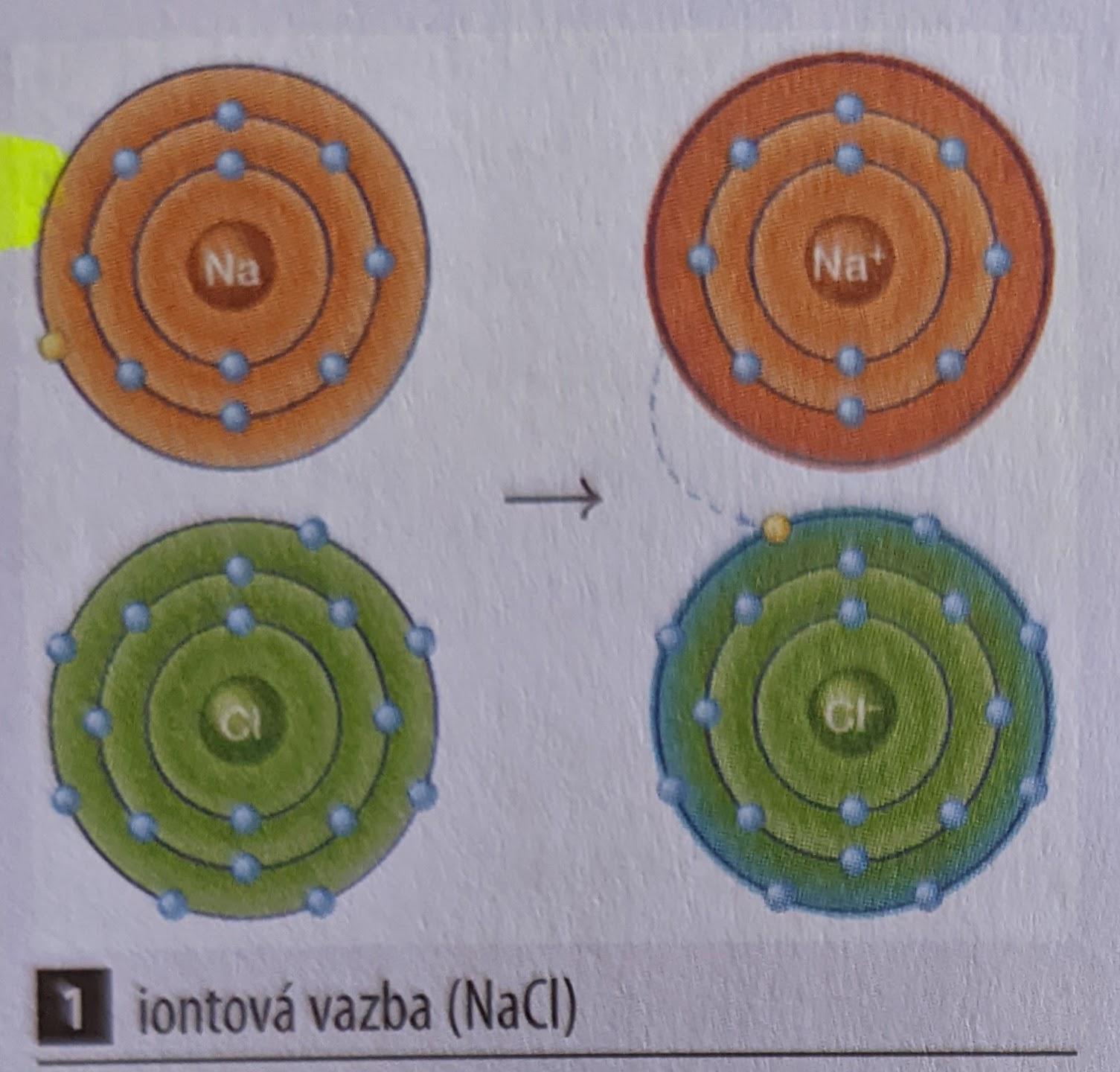
- Rozdíl elektronegativit vázaných atomů prvků je větší než 1,7
- Elektopozitivnější atom tak předá elektron druhému atomu a vznikne kladně nabitý iont (kation) a záporně nabitý ion (anion)
Kovová vazba

- Je tvořena volně se pohybujícími elektrony ve struktuře kovu
- Tyto elektrony jsou uvolněny z kationtů kovu, které tvoří samotnou strukturu kovu
- Svým volně pohybujícím chováním jsou podobné plynu, proto elektronový plyn
Polární
- Vzniká mezi dvěma různými atomy jejichž rozdíl elektronegativit je větší než 0,4, ale menší než 1,7
Kovalentní vazba
- Vzniká mezi atomy, které mají ve valenční vrstvě alespoň jeden nepárový elektron
- Atomy se k sobě přiblíží, jejich valenční orbitaly překryjí a oba nepárové elektrony vytvoří elektronový pár

Nepolární
- Vzniká mezi dvěma stejnými atomy jejichž rozdíl elektronegativ nepřevyšuje 0,4
Vodíkové můstky
- Vyskytují se u sloučenin vodíku s prvkem o vysoké elektornegativitě (F, O, N)
- Atom vodíku jedné molekuly vytváří slabou vazbu s elektronegativnějším prvkem
- Elektornegativnjší prvek si elektrony přitahuje (má schopnost přitahovat ne sebe elktorny) a získává parciální záporný náboj, vodík má kladný protože na sebe nepřitahuje elektrony
- Způsobují vysoký bod varu
- Jsou polární ale musí tam být vázaný el. rvek
Jednoduchá vazba
- Vzniká sdílením jednoho elektronu
Polarita a elektronegativita
- Neurčuje se u násobných vazeb!
- Elektronegativita = schopnost atomů přitahovat elektrony
Násobnost vazeb
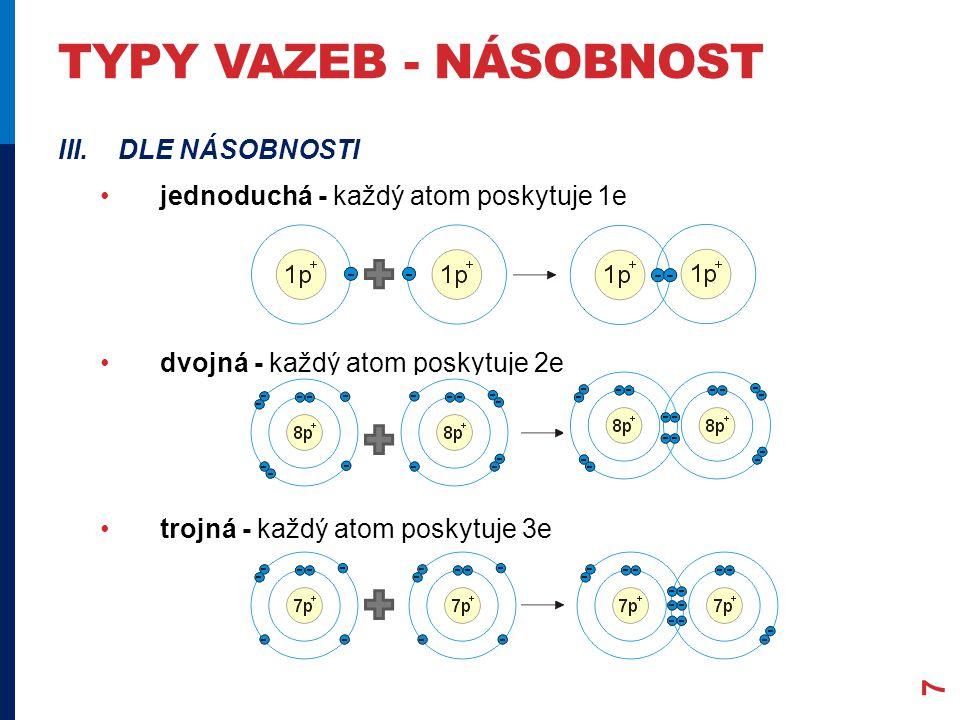
Dvojná vazba
49) Chemické vazby

- Vazba vzniká spojením atomů protřednictvím valenčních elektronů
- Vazba vzniká mezi atomy, které mají nestabilní elektronovou konfiguraci (1 - 7 valenčních elektronů)
Trojná vazba
sp
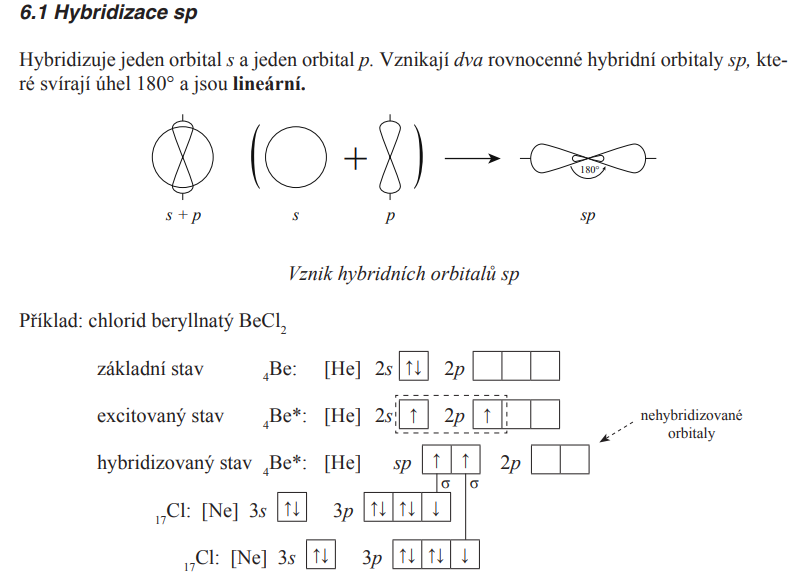
Hybridizace
- Energetické sjednocení různých orbitalů daného prvku
- Podílejí se na ni všechny orbitaly s výjimkou těch které tvoří vazbu Pí
- Neurčuje se u iontové vazby !!!
- Iontová vazba se nezapisuje pomocí rámečků
Sigma
- Vzniká překrytím valenčních elektronů na spojnici středů překrytých orbitalů
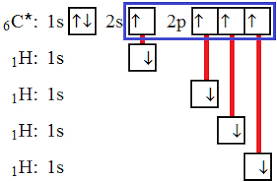
Procvičení


Pí
- Vzniká překrytím velenčních orbitalů mimo spojnici středů překrytých orbtalů
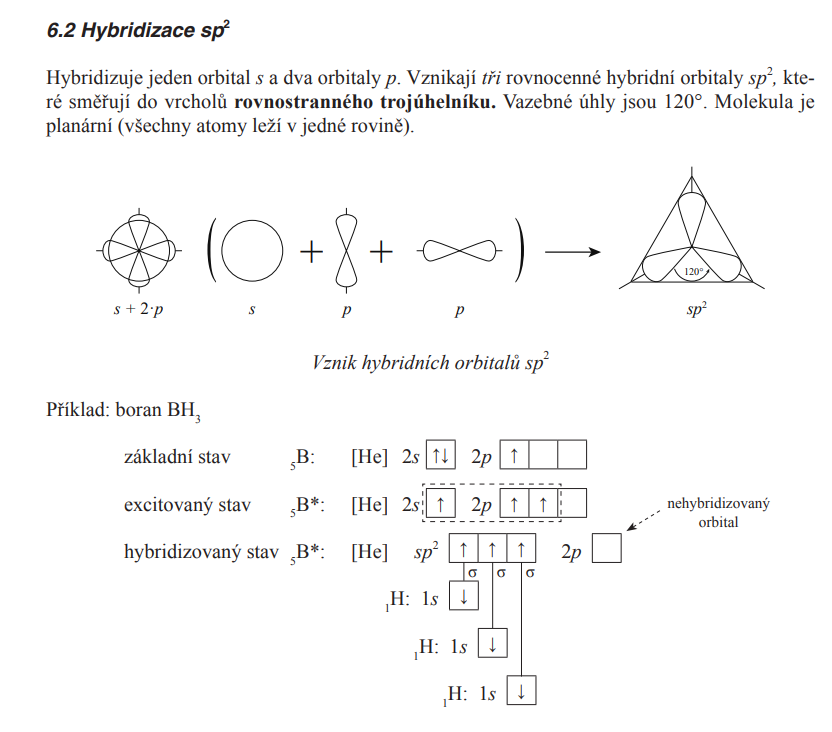
sp2
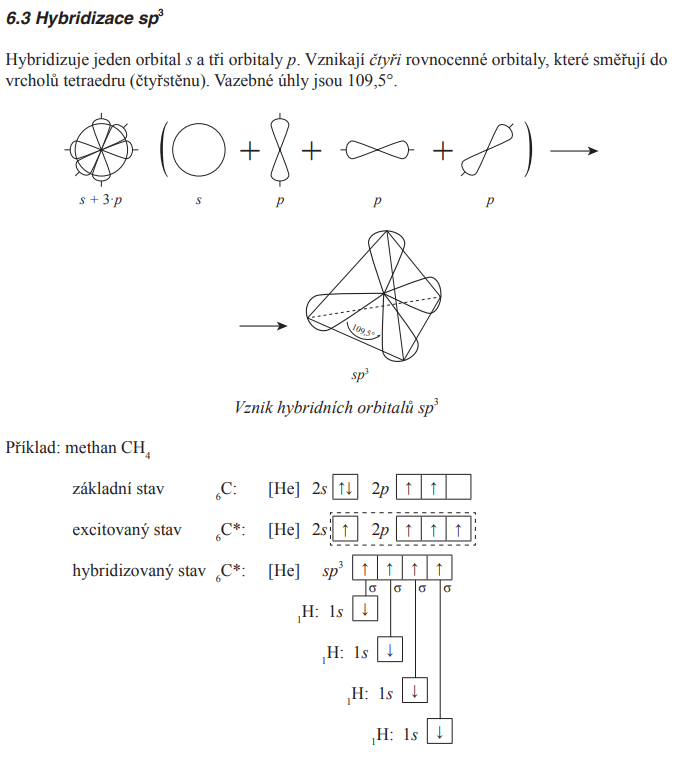
sp3

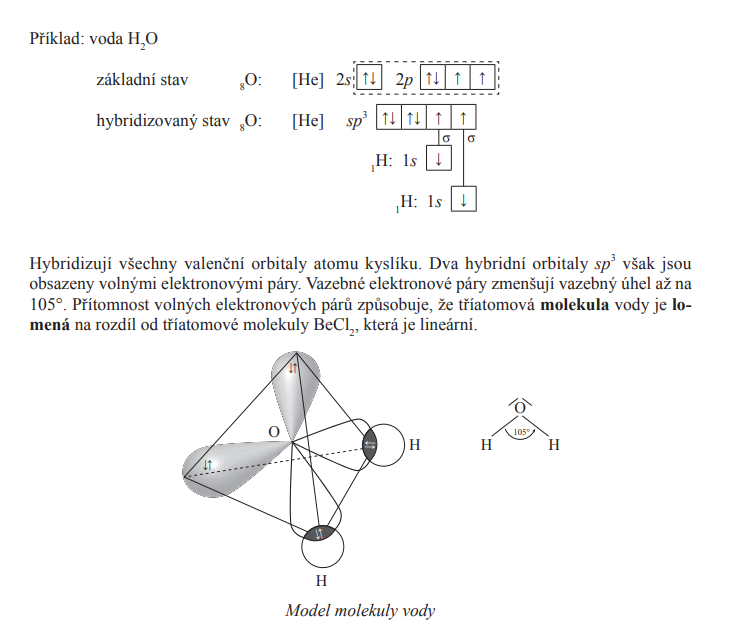
Druhy vazeb
Vlastnosti
Slabé vazebné interakce
Van der Waalesovy síly
Iontové interakce
Typy vazeb