33) Bílkoviny
Created by Martin Krejzek

Ketodieta
- Tvoří se v těle ketolátky a dochází k degradaci ledvin
α-helix
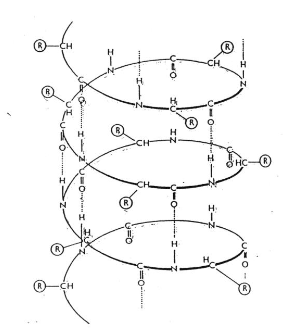
- Šroubovice
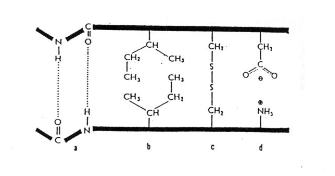
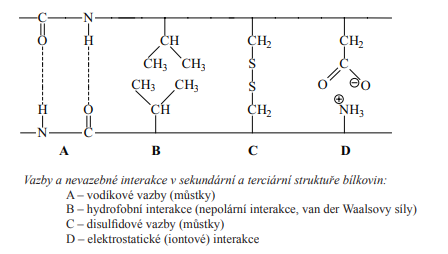
- Stabilizují ji vodíkové můstky (Parc. záporný náboj přitahuje všechny elektrony, polarita se neurčuje!!! A dusík taky přitahuje všechny elektrony) | Van der Waalesovy síly | disulfidické můstky a (vazba mezi sulfidy) a iontové interakce (+ a -)
Skládaný list
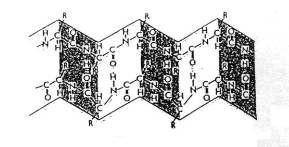
- ddfds
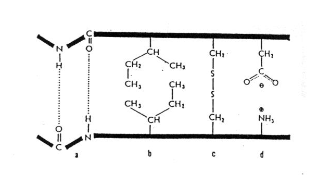
- Obrázek:
- V tmavých okýnkách je peptidická vazba
Imunitní funkce
- Produkuje protilátky na ochranu proti infekci
Vratná
- Bílkovina je schopna se navrátit zpět do předchozí struktury
- Není zničena funkce bílkoviny
Transportní funkce
Katalycká funkce
Regulační funkce
Stavební funkce
Kontraktivní funkce
Způsoby denaturace
- Teplota
- pH
- Ovocný čaj + mléko => srazí se
- Mechanický důvod
- Šlehačka > denaturace > máslo
- Pěna na řece
Nevratná
- Bílkovina změní funkce a je zničena
- Natrvalo změní fci a je zničena
Denaturace bílkovin
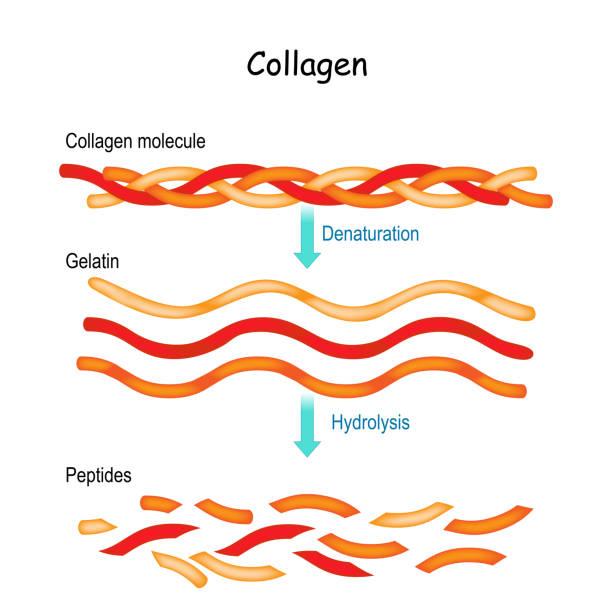
- Pro sekundární a terciální struktury je možná tzv. denaturace = změna prostorového uspořádání
Primární struktura
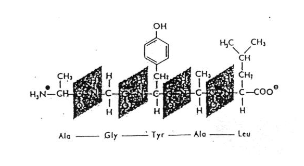
- dfd
- Je dána pořadím aminokyselin a pro každou bílkovinu je pořadí různě specifické
- Dále je dána geneticky
- Určuje vlastnosti a funkci bílkoviny
- Obrázek:
- Tmavý je peptidická vazba
- A pod ním jsou značky aminokyselin
Zásobní funkce
Sekundární struktura
- Je to prostorově uspořádaná primární struktura
+
- Když tělo zadržuje dusík ve formě bílkovin, v době růstu a rekonvalescence po těžké nemoci
- Tělo dusík nutně potřebuje
Terciální struktura
- Je to prostorové uspořádání sekundární struktury
Struktura bílkovin
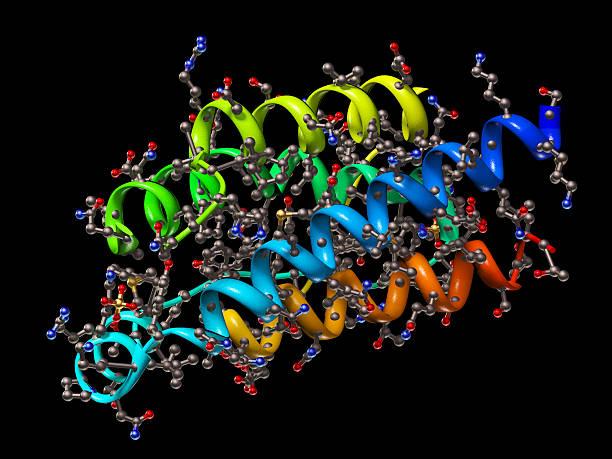
-
- Když dochází ke ztrátám dusíku a k úbytku bílkovin v době velmi těžké nemoci
- To se musí kopenzovat nutri drinkama
Fibrilární (vláknitý)
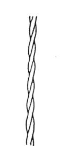
- Jsou špatně nebo nerozpustné ve vodě
+ a -
- Vyrovnaná bilance
- Tělo co přijme, to zároveň i vydá
Kvarterní struktura
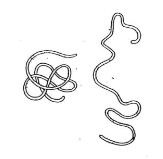
- Vzájemné prováznání řetězců
Dusíková bilance
- Rozdíl mezi/nad přijatým a vydaným dusíkem
- N = ∑Npříjmu - Nvýdeje
- Obecně to znamená že dusík můžeme přijímat nebo odvádět a podle toho máme nějakou bilanci
Globulární (kulovité)
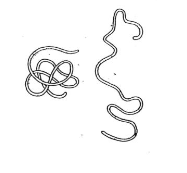
- Jsou rozpustné ve vodě
- Obrázek:
- Ten rozpletený copánek znázorňuje denaturaci
Jednoduché bílkoviny
- Obsahují pouze peptidické řetězce
33) Bílkoviny

- Makromolekulrání látky složené z α-aminokyselin (mají aminoskupinu v poloze 2)
- V bílkovinách se běžně vyskytuje jen 20 aminokyselin
- Zpaměti umět glycin a alanin
Složené bílkoviny
- Obsahují včetně bílkovinné části i nebílkovnou část (prostetická část)
Aminokyseliny

- Stavební jednotky bílkovin
- Všechny musí mít konfiguraci L (ve Fischerově projekci jsou nalevo)
- D forma už bílkoviny nevytvoří
- Jsou opticky aktivní až na glycin
- Protože α-uhlíkový atom je obvykle chirální
- Spojují se peptidickou vazbou a vytváří peptidy (2-99 aminokyselin bílkoviny více nbež 100)
- Některé jsou esenciální (jsou nutné pro život ale my je neumíme syntetizovat)
- Jsou to amfoterní látky, mají schopnost tvořit bipolární iont
- Protože obsahují v molekule kyselou skupinu -COOH a zásaditou skupinu -NH2
- pH při kterém se objevuje bipolární iont se nazývá izoelektrický bod [pI]
Peptidy

Klasifikace bílkovin
Funkce bílkovin
Vodíkové můstky
- Vyskytují se u sloučenin vodíku s prvkem o vysoké elektornegativitě (F, O, N)
- Atom vodíku jedné molekuly vytváří slabou vazbu s elektronegativnějším prvkem
- Elektornegativnjší prvek si elektrony přitahuje (má schopnost přitahovat ne sebe elktorny) a získává parciální záporný náboj, vodík má kladný protože na sebe nepřitahuje elektrony
- Způsobují vysoký bod varu
- Jsou polární ale musí tam být vázaný el. rvek
Tvary molekuly bílkoviny
Kreatin
Aktin | myosin
Kolagen
Fibrinogen a fibrin
Fibrinogen je rozpustný a fibrin nerozpustnáý (strup)
Imunoglobuliny [Ig]