1) Atom
Created by Martin Krejzek

1) Atom
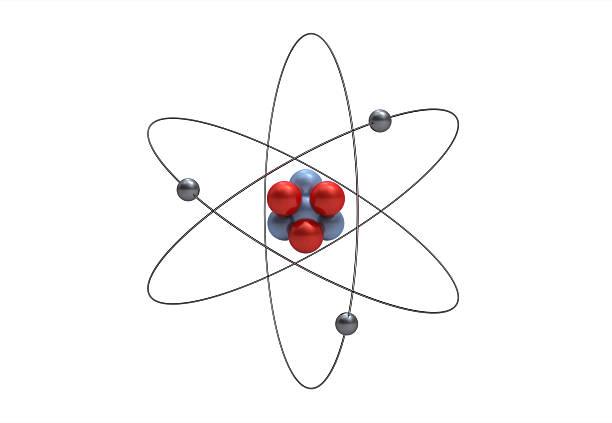
- Atom je základní částice, ze které se skládá hmota
- Základní stavební částice všech látek
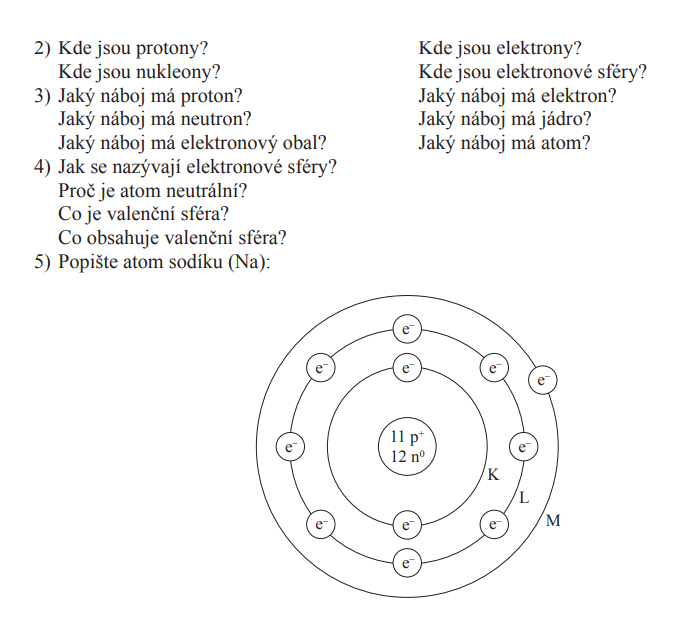
- Struktura atomu je tvořena z kladně nabitého jádra (obsahuje mnohem více protonů než elektronů) a ze záporně nabitého elektronového obalu (naopak)
- Elektrony obklopují jádro a podílejí se na vrstvách okolo atomu a zároveň definují chemickou povahu atomu
Atomové jádro
- Jádro atomu je tvořeno těmi nejmenšími částicemi hmoty, skládá se z:
- Protonů (Z) = pozitivně nabitá částice
- Pozitrony = vznikají rozpadem protonu
- Neutronů (N) = částice s neutrálním/nulovým nábojem
- Vznikají rozpadem neutronu
- Jejich počet v jádře udává nukleonové číslo (A)

Složky atomu

- Počet protonů = atomové číslo
- Každý atom daného prvku má tolik elektronů jako má protonů, avšak počet neutronů může být různý
- Izotopy = Atomy se stejným počtem protonů, ale jiným neutronů
- Nuklidy => Z = N = A

Elektronový obal

- Je to vrstva elektronů, která obklopuje jádro atomu
- V obalu je celkem 7 elektronových sfér, které se liší počtem elektronů
- K,L,M,O,P,Q
- Elektronová vrstva K obsahuje max. 2 e-
- Elektronová vrstva L obsahuje max. 8 e-
- Čím dále je vrstva od jádra, tím vyšší má energii
Orbitaly
- Orbitaly jsou oblasti, ve kterých se nacházejí elektrony nějakého atomu
- A proto každý atom má určité množství orbitalů, které se odlišují svou energií a potažmo svou konfigurací
- Je to také oblast nejpravděpodobnějšího výskytu elektronů
- Rozlišujeme proto 4 typy orbitalů, lišící se různými rozměry atd:
- Charakterizují je 4 kvantová čísla
s (1)
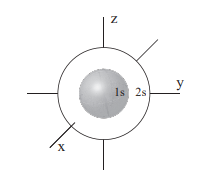
- l = 0
- m = 0
- Má proto taky 0 orientací
- Má 1 nebo 2 elektrony
p (3)
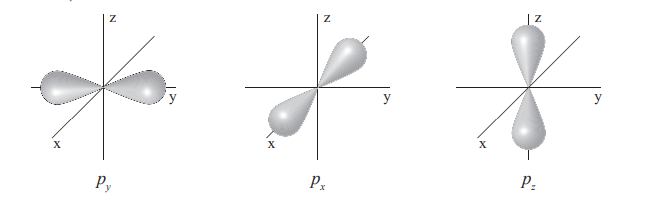
- l = 1
- m = 3 <-1; 0; 1>
- Má 6 elektronů
d (4)
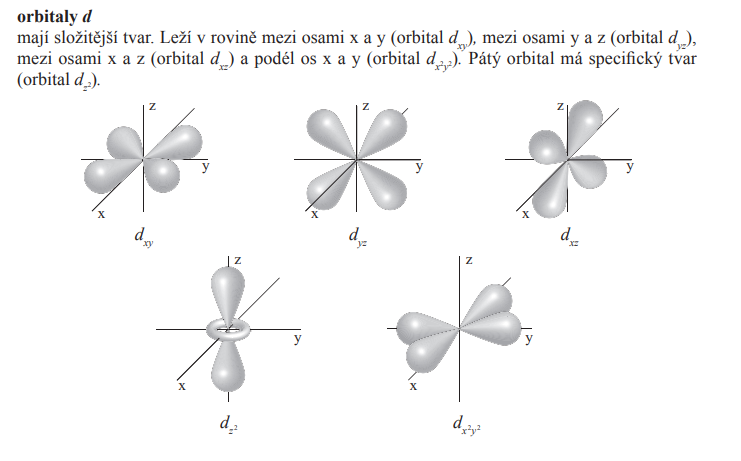
- l = 2
- m = 5 <-2; -1; 0; 1; 2>
- Má 10 elektronů
f (7)
- l = 3
- m = 7 <-3; -2; -1; 0; 1; 2; 3>
- Má 27 elektronů
Znázornění orbitalů

Pauliho princip
- V jednom orbitalu mohou být max. 2 elektrony s opačným nábojem
Kvantová čísla
- Hlavní kvantové číslo (n)
- Určuje celkovou energii ve sféře
- Udává vrstvu ve které se atom nachází
- Vedlejší kvantové číslo (l)
- Určuje typ orbitalu a energii v tomto orbitalu
- <0; n-1>
- Magnetické číslo (m)
- Udává orientaci v prostoru
- <-l;0;+l>
- Spinové číslo (s)
- Udává rotaci elektronu pouze ve 2 směrech
- +- 1/2

Valenční vrsta
- Vrtva kde se nacházejí elektrony s nejvyšší energií
- Je to poslední elektronová sféra
- Obsahuje tzv. valenční elektrony
- Příklad:
- Konfigurace dusíku: 1s2 2s2 2p3 = 5 valenčních elektronů

Excitace
- K excitaci dochází, když se atomu dodá energie, aby po tom mohl přecházet do vyšší energetické úrovně
- Excitace atomů je proces, ve kterém atom změní energetickou úroveň, přesouvajíc se z nižší úrovně energie na vyšší
- Pravidla:
- Ve valenční vrstvě musí být elektronový pár
- Atom musí mít své vlastní volné orbitaly, do kterých elektron z roztrženého páru přejde
- Když orbitaly nemá, může si půjčit ale pouze ty se stejným hlavním kvantovým číslem a z té nejbližší vrstvy

- vAL. el. niklu: má 2 elektrony
- n = 1,2,3,4
- l = 0,1,2,3
- m = <-3;+3>
Procvičení



- Proč má D orbital vůbec existuje?
- Má 5 kvantových čísel
- 3 vedlejší <-l;0;+l> => <-3;-2;-1;0;1;2;3>
Jaké je vedlejší kvantové číslo olova?
- Je to 5
- A hlavní je od 1 do 6
Jaká je stabilní konfigurace křemíku?
-4 nebo +4 => tím bude stabilní
Jaký je počet valenčních elektronů atomu kobaltu?
Má ve 4. vrstvě (v té valenční) pouze 2 elektrony