3) Termochemie
Created by Martin Krejzek

3) Termochemie
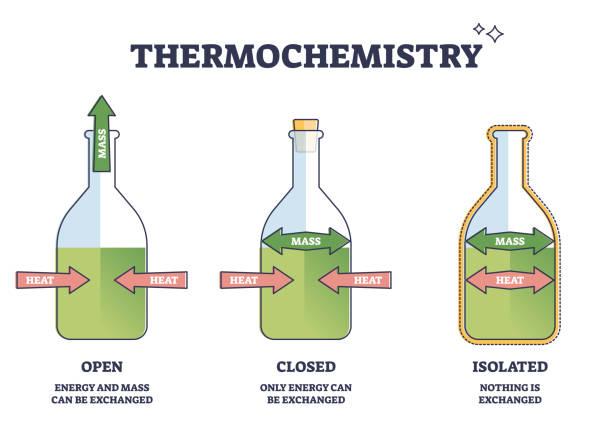
- Je to část termodynamiky, která se zabývá tepelnými změnami při chemické reakci
Termochemické zákony
1. Termochemický zákon
- Pokud reakce probíhají za stejných podmínek, je reakční teplo přímé a zpětné reakce stejné, liší se pouze znaménkem
- Přímá má pozitivní znaménko a zpětná negativní
- Reakční teplo je definováno jako pozitivní, pokud je na konci reakce vyprodukováno více energie než na jejím počátku a negativní, pokud na konci reakce dojde ke snížení energetického stavu systému
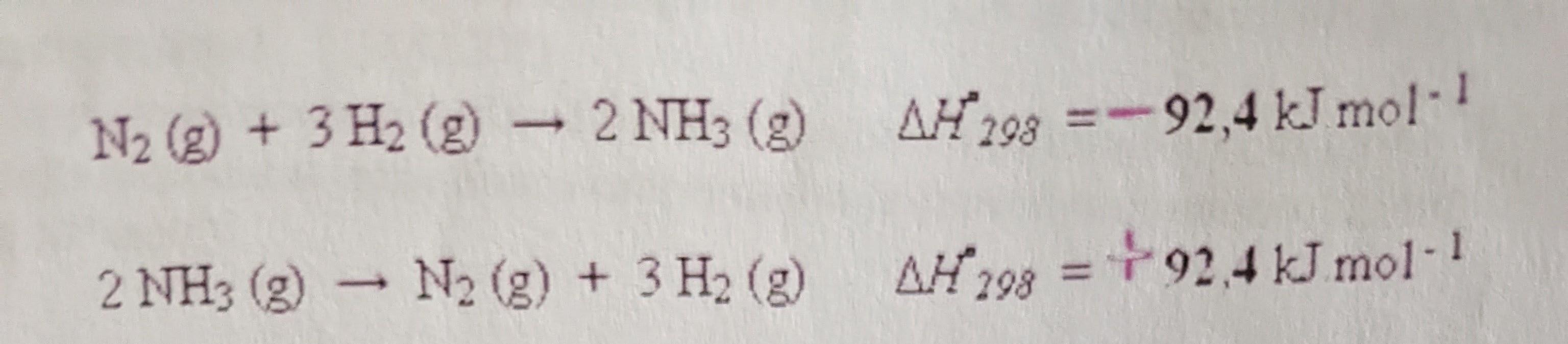
2. Termochemický zákon
- Reakční teplo kterékoli chemické reakce nezávisí na způsobu jejího průběhu, ale pouze na počátečním a koncovém stavu soustavy
Veličiny se kterými se počítá

- Termodynamická teplota
- T [K]
- Oo = 273,15 K
- 100 = 283,15 K
- Standartní podmínky
- Teplota a tlak při které je výchozí látka nejstálejší
- Označují se X0
- T (standartní) = 298,15 K
- p (standartní) = 101,325 Pa
Reakční teplo
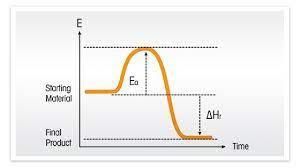
- Je teplo, které se uvolní nebo spotřebuje při reakci
- Je to teplo potřebné k tomu, aby se reakce uskutečnila
- Značí se entalpií
- [Δ H] v kJ/mol
- Není to jenom v Kj protože to závisí i na množství
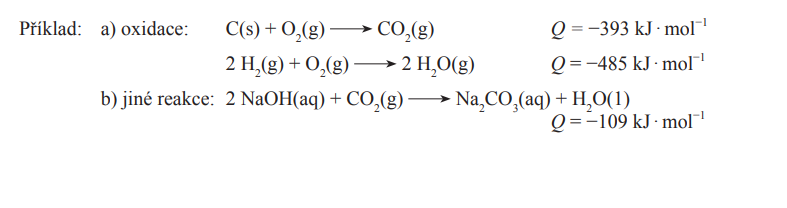
Enthalpie
- Reakční teplo, jen v případě když chemická reakce probíhá za konstantního tlaku a ne standartních podmínek
- Enthalpie je chemické množství energie, které musí být vloženo (nebo absorováno) do reakce, aby se uskutečnila
- [Δ H] v kJ/mol pouze za konstantího tlaku
- Není to jenom v Kj protože to závisí i na množství
- Jinak je teplo Q
- Může být pozitivní nebo negativní
Endotermická reakce
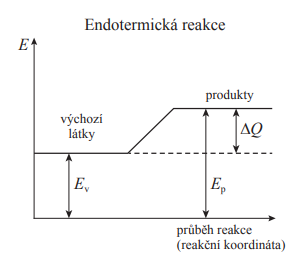

- Je reakce, při které se teplo spotřebovává
- Soustava teplo pohlcuje, přijímá ho z okolí
- Platí délta H > 0
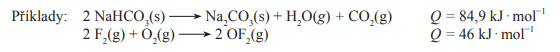
Exotermická reakce
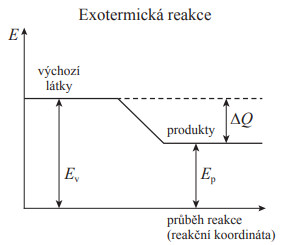

- Je reakce při které se teplo uvolňuje do prostředí
- Reakční teplo má dle konvence zápornou hodnotu Q<0, protože produkty obsahují méně energie než výchozí látky
- Platí délta H < O
Počítání
Podle energie vazeb


- Produkty mají záporné číslo
Podle spal. a sluč. tepel


Nesmusím vůbec žádné double závorky …
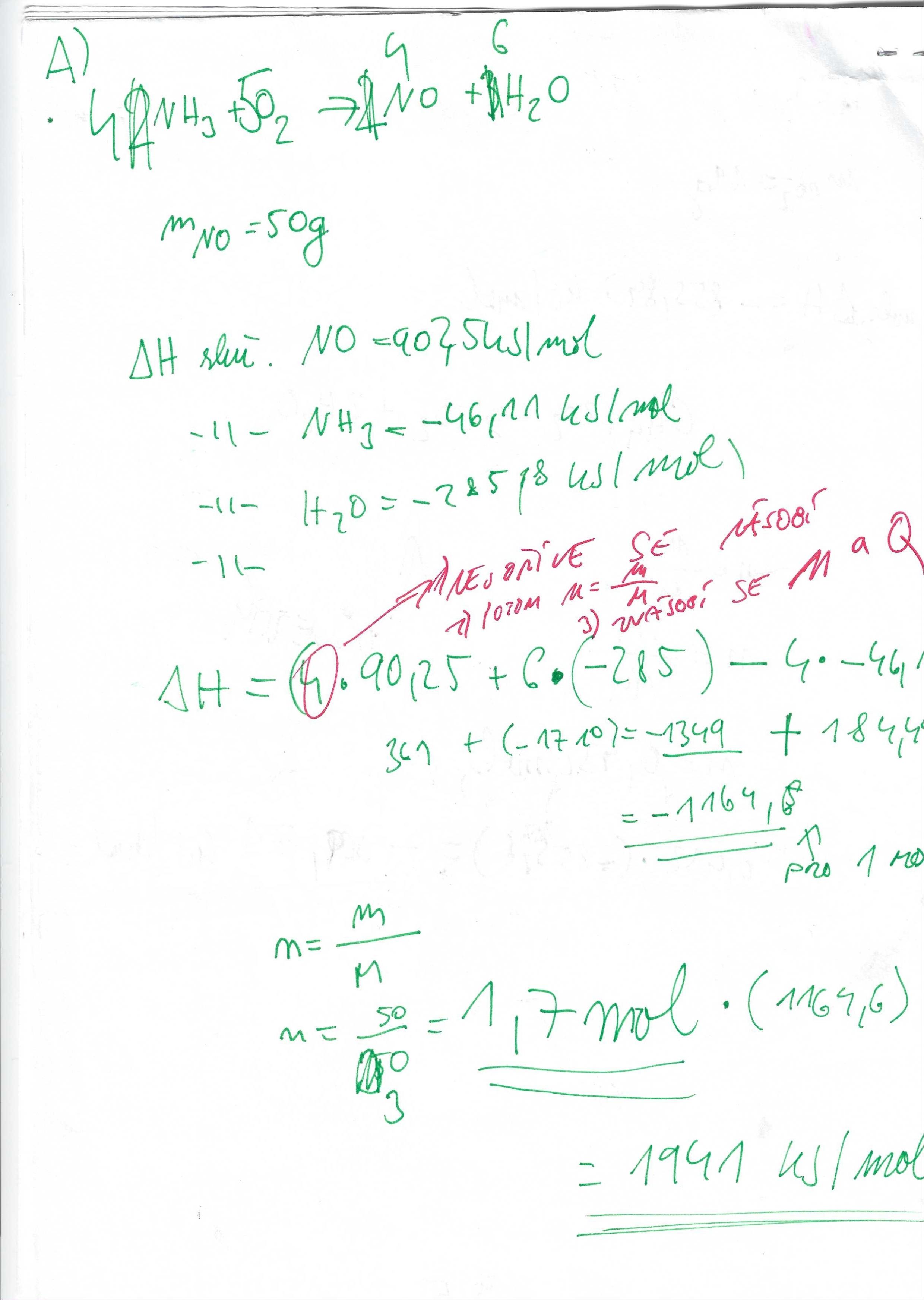
Spalné teplo
- Součet spalných tepel reaktantů - součet spalných tepel produktů
Slučovací teplo
- Součet slučovacích tepel produktů - součet slučovacích tepel reaktantů
Procvičení

- Q
- Qp = molární standartní teplo